Análisis longitudinal del microbioma rectal en perros con diabetes mellitus tras el inicio del tratamiento con insulina.
Se han realizado numerosos estudios en humanos y roedores que corroboran el papel del microbioma gastrointestinal en la patogénesis y la progresión de la diabetes mellitus de tipo 1 y 2. La diabetes mellitus es una endocrinopatía común en los perros; sin embargo, se sabe poco sobre la composición del microbioma intestinal durante el desarrollo y el tratamiento de la diabetes en esta especie.
El objetivo de este estudio piloto era caracterizar el microbioma gastrointestinal de los perros con diabetes mellitus en el momento del diagnóstico y durante las primeras 12 semanas de tratamiento con insulina e identificar las asociaciones con el control glucémico. Se recogieron hisopos rectales y suero para medir la fructosamina de 6 perros diabéticos recién diagnosticados a intervalos de 2 semanas durante 12 semanas.
Las muestras rectales se secuenciaron utilizando cebadores 16S, ITS y arqueas. Se evaluaron las medidas de diversidad alfa y beta para ver si había cambios a lo largo del tiempo; se identificaron las asociaciones entre las abundancias relativas de las variantes de secuencia absolutas (ASV) y el tiempo y la concentración de fructosamina mediante un modelo de efectos lineales multivariante específico para el microbioma.
No se observaron cambios estadísticamente significativos a lo largo del tiempo en la diversidad alfa y las muestras se agruparon significativamente por perro y no por tiempo en el análisis de la diversidad beta.
Sin embargo, múltiples ASV se asociaron negativa (Clostridium sensu stricto 1, Romboutsia, Collinsella) y positivamente (Streptococcus, Bacteroides, Ruminococcus gauveauii, Peptoclostridium) con el tiempo y dos ASV se asociaron positivamente con la fructosamina (Enterococcus, Escherichia-Shigella). Estos cambios en la composición microbiana gastrointestinal justifican una mayor investigación sobre cómo pueden relacionarse con la progresión o el control de la diabetes mellitus en los perros.
Introduccion.
En la salud, el microbioma intestinal desempeña un papel clave en una serie de procesos fisiológicos, como la absorción de nutrientes, el metabolismo energético, la regulación inmunitaria y el mantenimiento de la barrera gastrointestinal [1-4]. Por el contrario, las alteraciones del microbioma, denominadas disbiosis, se asocian a una serie de enfermedades, incluida la diabetes mellitus (DM) [5, 6]. La evidencia actual sugiere que la disbiosis contribuye al desarrollo de la DM e interfiere con su manejo exitoso a través de una variedad de mecanismos.
La inflamación se propone como un vínculo fundamental entre el microbioma intestinal y la DM. En estos pacientes, la disbiosis se caracteriza generalmente por un aumento de patógenos oportunistas que generan inflamación de bajo nivel y estimulan la producción de mediadores inflamatorios. Al mismo tiempo, hay una disminución de las poblaciones bacterianas que producen ácidos grasos de cadena corta (AGCC), como el butirato, que son esenciales para la salud del epitelio intestinal y la inmunotolerancia de la flora intestinal normal.
Por lo tanto, la disminución de la producción de butirato conduce a un deterioro de la función de la barrera de la mucosa y perpetúa aún más los efectos sistémicos de la inflamación intestinal. El microbioma intestinal tiene efectos adicionales sobre el control glucémico del huésped. Los AGCS, los indoles y otros mediadores estimulan la liberación de hormonas incretinas, que son un factor determinante de la liberación de insulina postprandial.
La modulación de la reserva de ácidos biliares por parte de los microbios intestinales también influye en la secreción de incretina y altera el manejo hepático de la glucosa y el glucógeno. Además, la microbiota entérica influye en la función del tejido adiposo, que desempeña un papel importante en la regulación metabólica. Así pues, parece haber una relación compleja entre el microbioma intestinal y el estado glucémico.
En la DM tipo 1, se sospecha que la disbiosis y la inflamación intestinal estimulan el sistema inmunitario, lo que puede contribuir o desencadenar la destrucción autoinmune del páncreas endocrino. Esta teoría está apoyada por los cambios progresivos en los marcadores de disbiosis en niños con DM tipo 1 a lo largo del tiempo, desde antes de la seroconversión hasta el desarrollo de autoanticuerpos a la hiperglucemia manifiesta.
Además, se ha demostrado que la manipulación temprana del microbioma intestinal retrasa la aparición de la DM de tipo 1 en modelos de ratón. En la DM de tipo 2, se cree que los mediadores inflamatorios de la inflamación intestinal de bajo nivel inducen la resistencia a la insulina, contribuyendo tanto al desarrollo como a la perpetuación de la hiperglucemia. Varios estudios han documentado la presencia de disbiosis en los diabéticos de tipo 2, incluyendo asociaciones entre las abundancias relativas de las especies y los marcadores de la regulación diabética, como la glucemia en ayunas y la hemoglobina a1c.
A pesar de la creciente evidencia en medicina humana, el papel del microbioma en la DM canina es relativamente desconocido. La DM es una endocrinopatía común en los perros con una prevalencia reportada de aproximadamente 0,34-1,2% . Aunque no se clasifica típicamente como tipo 1 o tipo 2, los perros tienen características de ambos con una deficiencia absoluta de insulina debido a la destrucción de las células de los islotes pancreáticos y factores concurrentes que promueven la resistencia a la insulina y complican la regulación.
Dadas las similitudes entre la DM humana y la canina, es posible que la DM canina también esté asociada a la disbiosis. Hasta la fecha, sólo un estudio ha evaluado esta hipótesis. Este estudio transversal descubrió que los perros diabéticos no presentaban una diferencia estadística en la diversidad alfa en comparación con un grupo de perros de control, aunque sí tenían una mayor abundancia relativa de Enterobacteriaceae en comparación con los controles sanos.
Sin embargo, este estudio sólo analizó un único punto temporal e incluyó perros en varias fases de tratamiento y control diabético; por lo tanto, no se pueden hacer inferencias sobre las alteraciones del microbioma en el momento del diagnóstico o las transiciones durante el tratamiento. Así pues, el impacto del tratamiento de la DM en el microbioma gastrointestinal de los diabéticos caninos sigue siendo desconocido.
El estudio descrito aquí fue un estudio piloto longitudinal y prospectivo que evaluó el microbioma rectal de perros diabéticos recién diagnosticados durante las primeras 12 semanas de tratamiento. El objetivo principal de este estudio era caracterizar el microbioma gastrointestinal de los perros con DM en el momento del diagnóstico y durante el tratamiento.
Nuestra hipótesis era que inicialmente habría cambios en la diversidad y composición del microbioma rectal de los perros diabéticos desde el momento del diagnóstico hasta las primeras 12 semanas de tratamiento. En concreto, la hipótesis era que la diversidad alfa aumentaría con el tiempo de tratamiento y que la abundancia relativa de patógenos oportunistas, como las Enterobacteriaceae, disminuiría, mientras que los organismos productores de butirato, como los Firmicutes, aumentarían a medida que avanzara el tratamiento.
Un objetivo secundario era evaluar la abundancia de los taxones microbianos en relación con la fructosamina del paciente, como marcador cuantitativo del control diabético. Nuestra hipótesis era que habría correlaciones significativas entre la fructosamina y la abundancia relativa de uno o más taxones en este estudio.
Material y métodos.
Los Perros.
Se reclutaron perros diabéticos recién diagnosticados a través de clínicas veterinarias de atención primaria asociadas. Los perros se presentaron por los signos clínicos relacionados con su enfermedad. En el momento del diagnóstico, a todos los perros se les realizó un recuento sanguíneo completo, un perfil bioquímico sérico, un análisis de orina, un cultivo de orina, concentraciones séricas de tiroxina total, fructosamina, cobalamina y folato, inmunoreactividad similar a la tripsina (TLI) e inmunoreactividad de la lipasa pancreática (PLI) para descartar enfermedades concurrentes.
Se excluyeron los perros si los diagnósticos indicaban una enfermedad concurrente, como una infección del tracto urinario, una insuficiencia pancreática exocrina o una neoplasia. No se excluyeron los perros con aumento de TLI, PLI o enzimas hepáticas. Además, se excluyeron los perros que recibieron antibióticos en las 4 semanas anteriores a la inscripción o durante el periodo del estudio y los perros que tuvieron un cambio de dieta en las 4 semanas anteriores a la inscripción o durante el periodo del estudio.
Se confirmó que todos los perros comían un alimento comercial para perros, nutricionalmente equilibrado, y que seguían esa misma dieta durante al menos un mes antes del inicio del estudio. Los perros se mantuvieron con su dieta anterior a la investigación durante todo el estudio. Si los perros admitidos requerían antibióticos, desarrollaban una enfermedad o sufrían un cambio en la dieta, se excluían de seguir participando, pero las muestras recogidas antes de la desviación del protocolo se incluían en el análisis. El manejo de la diabetes, incluida la elección y la dosis de insulina, quedó a discreción del veterinario de atención primaria.
Los perros fueron evaluados cada 2 semanas durante las primeras 12 semanas de tratamiento con insulina, momento en el que se registró el peso, se recogió suero para la medición de la fructosamina, se obtuvieron hisopos rectales y se completaron cuestionarios por parte del propietario y del veterinario de atención primaria (Archivo S1). Los cuestionarios incluían información sobre la raza, el peso, las puntuaciones de la condición corporal y muscular, el sexo, la edad, la dieta, los antecedentes de medicación, el apetito, la ingesta de agua y la micción, el nivel de actividad, la dosis y el tipo de insulina, y la evaluación subjetiva del control. El protocolo fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Illinois (Protocolo nº 18043).
Recogida y manipulación de muestras de hisopos rectales.
Los veterinarios de atención primaria recogieron hisopos rectales, suero y orina. Se introdujeron hisopos estériles (Copan FLOQSwab; Copan Inc., Murrieta, CA) en el recto y se barrieron con un movimiento circular. Los hisopos se colocaron en un recipiente seco. Las muestras se enviaron el mismo día o se almacenaron durante la noche a 4°C. Las muestras se enviaron durante la noche en hielo. Una vez recibidas, el suero y la orina se procesaron el mismo día y los hisopos rectales se almacenaron a -80°C hasta que se realizó la extracción de ADN.
Extracción de ADN
El ADN se extrajo de los hisopos rectales utilizando el QIAamp PowerFecal Pro Kit DNA (QIAGEN, Hilden, Alemania) siguiendo el protocolo del fabricante, con la excepción de que los hisopos rectales se utilizaron en el paso inicial de batido de cuentas en lugar de las heces. Para evaluar el grado de contaminación microbiana en los hisopos y reactivos, también procesamos un hisopo estéril (sin usar) y 200 μL de agua estéril sin nucleótidos en lugar de los hisopos rectales en el protocolo de extracción de ADN. La concentración de ADN en los extractos se determinó utilizando un espectrofotómetro NanoDrop 1000 (ThermoFisher Scientific, Waltham, MA) con comprobación de la calidad mediante electroforesis en gel de agarosa.
Preparación de la biblioteca y secuenciación.
Las muestras de hisopo rectal se enviaron para la cuantificación relativa de eubacterias, arqueas y hongos en el Centro de Biotecnología de la Universidad de Illinois. Además de las muestras de hisopo rectal, se enviaron los dos controles negativos de la extracción de ADN y un control negativo adicional consistente en agua estéril sin nucleótidos.
En primer lugar, se preparó la biblioteca de secuenciación mediante el sistema Fluidigm Access Array (Fluidigm Corporation, South San Francisco, CA) utilizando los siguientes cebadores V3_F357_N (5-CCTACGGNGGCWGCAG-3) y V4_R805 (5-GACTACHVGGGTATCTAATCC-3) para la región V3-V4 del ARNr 16S eubacteriano; Arch349F (5-GYGCASCAGKCGMGAAW-3) y Arch806R (5-GGACTACVSGGGTATCTAAT-3) para el ARNr 16S arqueano; e ITS3 (5-GCATCGAATGAAGAACGCAGC-3) e ITS4 (5-TCCTCCGCTTATTGATATGC-3) para la región del espaciador transcrito interno 2 de las especies fúngicas. La secuenciación se llevó a cabo en la plataforma Illumina MiSeq (Illumina, Inc., San Diego, CA) utilizando lecturas de extremos emparejados de 250 pb.
Procesamiento bioinformático de las secuencias.
El procesamiento de las secuencias en bruto se realizó con el software Quantitative Insights into Microbial Ecology (versión 2). Las secuencias se desmultiplexaron primero para eliminar las secuencias índice específicas de la muestra. Se utilizó el plugin Dada2 para generar una tabla de características de variantes de secuencia absoluta (ASV). La taxonomía de las ASV se asignó utilizando la base de datos de referencia SILVA (versión 138.1).
Las secuencias demultiplexadas y alineadas se procesaron posteriormente utilizando el paquete R phyloseq. Las ASVs con un filo no asignado fueron eliminadas y las ASVs restantes fueron filtradas para excluir los taxones de baja abundancia utilizando un umbral de prevalencia del 50%. Finalmente, la matriz de recuento filtrada se aglomeró en el nivel taxonómico de género.
Análisis estadístico.
Los datos demográficos y clínicos se presentan de forma descriptiva. Todos los datos de secuenciación de amplicones se analizaron en el lenguaje R para programación estadística (versión 4.0.3; Bunny-Wunnies Freak Out) [20]. El índice de diversidad de Shannon (SDI), una estimación de la diversidad alfa, se calculó para cada muestra utilizando la matriz de recuento de ASV en bruto [21]. Se utilizaron modelos lineales generalizados de efectos mixtos para evaluar el efecto sobre el SDI del tiempo de recogida de muestras tras la administración de insulina.
Se utilizaron métodos no supervisados para detectar los cambios en la estructura de la comunidad de la microbiota asociados a diferentes puntos temporales tras el inicio del tratamiento con insulina. La diversidad beta se estimó mediante la matriz de disimilitud de Bray-Curtis, generada a partir de la matriz de recuento ASV filtrada y aglomerada, y se visualizó con el escalamiento multidimensional no métrico (NMDS).
Se utilizó el análisis multivariante de la varianza (PERMANOVA) para detectar diferencias estadísticas en la estructura de la comunidad microbiana entre los perros individuales y los puntos de recogida de muestras. El PERMANOVA se implementó en la matriz de disimilitud de Bray Curtis con 1.000 permutaciones utilizando la función adonis del paquete vegano.
Se utilizó la Asociación Multivariable del Microbioma con Modelos Lineales (MaAsLin2) para detectar ASVs diferencialmente abundantes entre los puntos temporales de recogida de muestras y las asociaciones entre ASVs y las concentraciones de fructosamina en suero. La matriz de recuento de ASVs fue normalizada por el método de escala de suma total (TSS) y transformada logarítmicamente antes del análisis.
Para comprender el impacto de las pruebas múltiples, se calculó una estimación de la tasa de falsos descubrimientos (FDR) utilizando el método de Benjamini-Hochburg. Los resultados se consideraron estadísticamente significativos cuando el valor p bruto era < 0,05, independientemente de la FDR.
Resultados.
Población.
Se incluyeron seis perros en el estudio, con un perro perdido en el seguimiento después de la sexta semana. Cuatro eran machos y 2 hembras, todos castrados. La edad media era de 7,3 años (rango 7,7-11) y el peso medio era de 16 kg (rango, 4,2-42,6). Las razas de perro representadas eran un chihuahua, un boyero australiano, un labrador retriever, un grifón de Bruselas, una mezcla de yorkshire terrier y un pomerania (tabla 1).
Todos los perros se presentaron a su veterinario de atención primaria con la queja principal de poliuria y polidipsia y se observó además que un perro había perdido peso y había desarrollado ceguera. Según los registros de atención primaria, todos los perros habían perdido peso desde el examen previo al diagnóstico de diabetes mellitus, pero cinco de los seis perros tenían sobrepeso. Cinco de los seis perros fueron tratados con insulina NPH y un perro fue tratado con insulina porcina en suspensión de zinc (Vetsulin, Merck Animal Health, De Soto, KS).
Parámetros clínicos de control de la diabetes mellitus.
El control de la diabetes se evaluó objetivamente mediante el seguimiento de la fructosamina sérica y el peso, y subjetivamente mediante la evaluación de la ingesta de agua, la diuresis y el apetito. Hubo una tendencia general a la baja de la fructosamina con el tiempo y el peso parecía estable durante el tratamiento.
La mayoría de los perros también tenían una ingesta de agua y una micción estables o normalizadas, según la evaluación de los propietarios, y todos tenían un mejor control subjetivo, según la evaluación del veterinario principal, desde el momento del diagnóstico en la semana 0 hasta la finalización del estudio en la semana 12.
Estadísticas de la secuenciación del 16S-ARNr.
Se generó un total de 3.581.921 secuencias a partir de 2036 ASV únicas. Excluyendo los controles negativos, la profundidad media de secuenciación fue de 96.462 lecturas por muestra (9.192-146.597). Para comprender el grado de contaminación ambiental y de reactivos, secuenciamos tres muestras de control negativo.
Generamos un total de 9.340 secuencias de 7 ASV únicas en las tres muestras de control negativo, casi todas ellas del filo Proteobacteria, incluyendo tres del género Escherichia-Shigella y una del género Azomonas. Las secuencias de Escherichia-Shigella representaban más del 89% de las ASV en las tres muestras de control negativo.
Tras eliminar las muestras de control negativo, filtrar las secuencias de baja abundancia y aglomerar los recuentos de ASV en el género, quedaron 2.649.900 secuencias de 29 ASV únicas, con una profundidad media de 73.224 (6962-110.625) secuencias por muestra.
Diversidad alfa y beta.
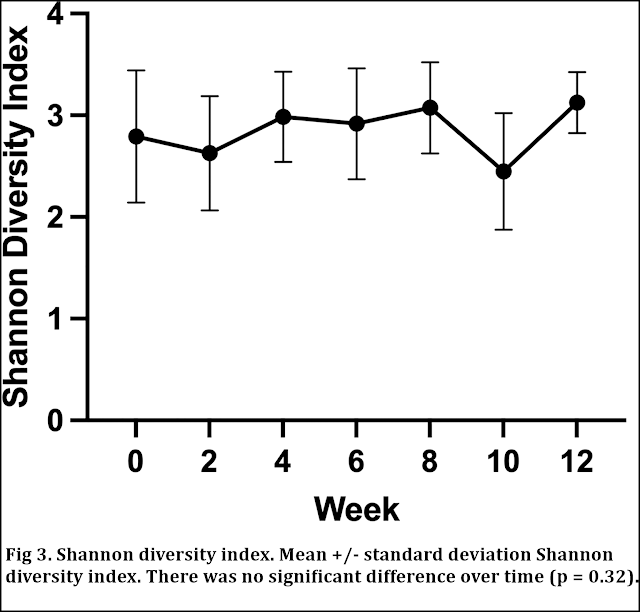
Se calculó el índice de diversidad de Shannon (SDI) para cada perro en cada punto temporal y se comparó a lo largo del tiempo y entre perros. No hubo diferencias significativas en el SDI a lo largo del tiempo (p = 0,32; Fig. 3). El escalado multidimensional no métrico (NMDS) de la matriz de disimilitud de Bray Curtis (Fig 4) y el PERMANOVA revelaron que el origen de la muestra con respecto a un perro individual era una fuente significativa de variación en las comunidades microbianas (R2 = 0,46; P = 0,01).
Hubo una separación de las muestras de dos perros (pacientes ID 8 y 11) recogidas antes de la administración de insulina (semana 0) recogidas después del inicio de la terapia de insulina, pero el punto de tiempo de recogida no fue una fuente de variación estadísticamente significativa en la estructura de la comunidad según el PERMANOVA (R2 = 0,02; P = 0,39).
Arqueas y hongos.
La mayoría de los amplicones de los cebadores de arqueas mapearon especies eubacterianas y sólo se detectaron 3 ASV de arqueas verdaderas, todas ellas aisladas de un solo perro. Del mismo modo, los cebadores ITS detectaron sólo 3 taxones de hongos, todos ellos pertenecientes al género Malassezia. Los cebadores ITS también produjeron un amplicón de un nematodo, Passalarus ambiguus.
Discusión.
En medicina humana, hay un creciente cuerpo de evidencia que sugiere que el microbioma intestinal contribuye al desarrollo y perpetuación de la DM. La disbiosis se reconoce sistemáticamente en múltiples estudios de diabéticos humanos y se asocia tanto con la autoinmunidad de las células de los islotes como con la resistencia a la insulina [5, 6]. Además, se ha demostrado que las alteraciones terapéuticas del microbioma mediante el uso de probióticos, el trasplante de microbiota fecal y las modificaciones dietéticas mejoran el metabolismo de la glucosa.
Por lo tanto, entender y manipular el microbioma en la DM tiene la posibilidad de mejorar los resultados clínicos de los pacientes diabéticos. En cambio, se sabe poco sobre el estado del microbioma intestinal en la DM canina. Terapias similares dirigidas al microbioma también podrían mejorar el control glucémico en perros, pero primero se requiere una mejor caracterización de la disbiosis asociada a la DM en estos pacientes.
En este estudio piloto, identificamos varios ASVs en el microbioma intestinal de perros diabéticos recién diagnosticados que cambiaron en abundancia relativa con el tiempo durante las primeras 12 semanas de terapia con insulina. Además, identificamos dos ASVs cuya abundancia relativa se correlacionó positivamente con la concentración de fructosamina en suero, un marcador comúnmente utilizado para el control glucémico en medicina veterinaria.
En el presente estudio, varios taxones bacterianos aumentaron su abundancia relativa durante las primeras 12 semanas de tratamiento con insulina. De ellos, el Bacteroides fue de especial interés. Se ha informado anteriormente de que Bacteroides spp. tiene efectos positivos sobre la tolerancia a la glucosa y la sensibilidad a la insulina. Este hallazgo es consistente en los estudios realizados en diabéticos humanos. En los estudios de casos y controles, la abundancia relativa de Bacteroides spp. suele disminuir en los diabéticos en comparación con los pacientes no diabéticos y, en los estudios de intervención, la abundancia relativa aumenta con las terapias para diabéticos.
Las Bacteroides spp. son algunas de las bacterias productoras de butirato mejor descritas y promueven la salud de los colonocitos y la integridad de las uniones estrechas. Así, se cree que la mejora de la sensibilidad a la insulina se produce a través de la reducción de la permeabilidad intestinal, la producción de LPS y la inflamación sistémica. Es posible que un mecanismo similar esté presente en los diabéticos caninos, lo que podría haber contribuido a la mejora general del estado clínico de los animales en el presente estudio.
También identificamos dos ASVs que disminuyeron en abundancia relativa durante el periodo de estudio, Roumboutsia y Clostridium sensu strictu 1; estos disminuyeron desde la línea de base en varios puntos de tiempo. En humanos con DM tipo 2, el aumento de la abundancia relativa de Roumboutsia se ha asociado con una mala tolerancia a la glucosa y una reducción de los niveles de insulina en ayunas. Por lo tanto, una disminución en la abundancia relativa durante las primeras 12 semanas de tratamiento de la DM puede representar un mejor control glucémico en nuestros perros de estudio.
Por el contrario, la abundancia relativa de Clostridium sensu strictu 1 está generalmente disminuida en pacientes humanos con DM tipo 2 y gestacional. Teniendo en cuenta este hallazgo, se podría esperar que la abundancia relativa aumentara con una mejor regulación diabética, en lugar de disminuir, como se observó en el presente estudio.
Sin embargo, la asociación entre Clostridium sensu strictu 1 y el estado metabólico se ha documentado principalmente en estudios transversales que comparan a los diabéticos con los controles sanos, y no en estudios longitudinales, por lo que la comparación directa entre éstos y el presente estudio puede no ser aplicable. Alternativamente, esta disparidad podría representar diferencias relacionadas con la especie en el microbioma intestinal y/o diferencias en la patogénesis de la DM entre humanos y perros.
Nuestro análisis también evaluó las correlaciones entre la abundancia relativa de ASV y las concentraciones de fructosamina en suero. La fructosamina es una medida indirecta de la glicosilación de las proteínas séricas, que aumenta durante la hiperglucemia crónica. Se utiliza habitualmente en combinación con los signos clínicos como medida del control diabético en pacientes caninos. Dos taxones bacterianos, Enterococcus y Escherichia-Shigella, se asociaron positivamente con la fructosamina sérica en este estudio.
Este último taxón, Escherichia-Shigella, es particularmente interesante ya que se ha documentado que la abundancia relativa de la familia Enterobacteriaceae, de la que son miembros Escherichia-Shigella, aumenta en los perros diabéticos en comparación con los controles sanos. Es importante señalar que Escherichia-Shigella es un contaminante común en los reactivos de laboratorio y las secuencias representaron >89% de los ASV en los 3 controles negativos de nuestro estudio.
Por lo tanto, la abundancia de Escherichia-Shigella en las muestras de los sujetos podría haber sido falsamente elevada. A pesar de esto, esperamos que la contaminación de los reactivos de laboratorio sea consistente en todas las muestras, por lo que la asociación positiva con la concentración de fructosamina en suero probablemente represente verdaderos procesos biológicos en lugar de contaminación.
Aunque identificamos cambios en las abundancias relativas de varias ASV, no identificamos ningún cambio significativo en la diversidad alfa o beta. Las medidas de diversidad alfa (por ejemplo, el índice de diversidad de Shannon) y beta (por ejemplo, el índice de disimilitud de Bray Curtis) detectan grandes cambios en la diversidad dentro de las poblaciones microbianas y entre ellas, respectivamente, pero son insensibles a los cambios en los taxones bacterianos individuales.
Así, es posible que se produzcan cambios significativos e importantes en las abundancias relativas de bacterias clave sin que ello afecte a las medidas de diversidad. De hecho, este fenómeno se produce habitualmente en los estudios que investigan el microbioma intestinal de los pacientes diabéticos humanos. La falta de cambios en las medidas de diversidad en nuestro estudio podría deberse a varios factores diferentes. En primer lugar, nuestro estudio se diseñó como un estudio piloto y, por tanto, su número de participantes fue limitado.
Es posible que se hubieran observado cambios más drásticos en la diversidad con más perros o con un curso de tiempo más largo. Además, es posible que la DM de algunos perros no estuviera adecuadamente controlada en la semana 12 de tratamiento, lo que podría haber dificultado la detección de cambios en la diversidad asociados al control glucémico. El tipo de insulina también varió entre los perros, lo que podría haber ocultado los cambios en la diversidad a lo largo del tiempo.
Es interesante observar que sólo un perro fue tratado con suspensión de insulina zinc porcina, mientras que los demás recibieron NPH. Este perro tuvo un descenso más precipitado de la fructosamina y, subjetivamente, el veterinario consideró que el perro estaba bien controlado. Por último, es posible que las alteraciones del microbioma intestinal durante la terapia diabética inicial en perros se deban más a los cambios en la abundancia relativa de unos pocos taxones clave que a las medidas generales de diversidad.
La mayor parte de las investigaciones sobre el microbioma se centran en la composición bacteriana, pero los organismos fúngicos y arqueos no suelen ser explorados a pesar de que se estima que comprenden el 1% y el 0,01-0,3% de las células microbianas en las muestras fecales, respectivamente. Dado que todos los ASV fúngicos generados en este estudio eran del género Malassezia, sospechamos que los organismos identificados procedían de la piel y no del recto debido al método de recogida.
No existe un método de recogida universal que proporcione una muestra representativa de todo el tracto gastrointestinal, pero la mayoría de los investigadores utilizan muestras fecales, ya que son fáciles de recoger y no son invasivas. Nuestros resultados podrían haber sido diferentes si se hubieran utilizado muestras fecales evacuadas, pero seleccionamos hisopos rectales para mantener la consistencia entre múltiples centros y asegurar que se recogieran muestras de cada visita. El hallazgo de P. ambiguus es inesperado, ya que se trata de un oxiuro específico de los conejos que no se conoce que infecte a los perros, y especulamos que representa la ingestión de ADN de oxiuros que pasaba por el tracto gastrointestinal del perro.
Una limitación importante del análisis de abundancia diferencial en este estudio es el alto FDR entre los resultados significativos. Muchos estudios similares utilizan el FDR como umbral de significación estadística, aceptando resultados con valores p ajustados por el FDR que van de <0,05 a <0,25. Los autores reconocen que éste sería un enfoque más sólido para asignar la significación estadística, en comparación con los valores p no ajustados (brutos).
Dado que se trata de un estudio piloto, hemos tratado de encontrar un equilibrio entre evitar los falsos descubrimientos y no descubrir diferencias reales que puedan servir de base para futuras investigaciones específicas. Por lo tanto, hemos proporcionado las estimaciones de la FDR para todos los resultados significativos para que el lector pueda comprender la probabilidad de que un resultado determinado sea un falso descubrimiento. Hacemos hincapié en que nuestros resultados deberían confirmarse en futuros estudios que utilicen muestras de mayor tamaño y enfoques específicos para cuantificar las comunidades microbianas.
Este estudio piloto se diseñó para caracterizar los cambios en el microbioma gastrointestinal de los perros con DM durante las primeras 12 semanas de tratamiento, no para asignar la causalidad entre la composición microbiana intestinal y la salud del huésped. Sin embargo, estos resultados demuestran cambios en el microbioma intestinal de los perros con diabetes durante el tratamiento inicial con insulina. Estas tendencias justifican la investigación futura en esta área, incluyendo estudios prospectivos sobre los cambios a largo plazo en el microbioma y cómo la modificación del microbioma con terapias como los probióticos o el trasplante de microbios fecales puede afectar al tratamiento de la diabetes en los perros.
Además, es esencial investigar la interacción entre la insulina y la terapia dietética en el microbioma de los perros diabéticos. En el presente estudio, mantuvimos a los perros en su dieta previa al diagnóstico para aislar mejor el efecto del tratamiento con insulina. Sin embargo, muchos veterinarios recomiendan un cambio de dieta como parte del tratamiento de la diabetes. El impacto de la combinación de cambio de dieta y terapia de insulina en el microbioma gastrointestinal podría tener implicaciones significativas para futuras terapias de perros diabéticos difíciles de regular.
Conclusiones.
Este estudio evaluó las alteraciones del microbioma intestinal en perros diabéticos recién diagnosticados con el objetivo de identificar los cambios correlacionados con el tiempo y la fructosamina. Aunque no se observaron cambios estadísticamente significativos en la diversidad, varias especies bacterianas tuvieron cambios en la abundancia relativa asociados con el tiempo y las concentraciones de fructosamina en suero. Los cambios identificados aquí justifican una mayor investigación para mejorar nuestra comprensión del papel del microbioma gastrointestinal en la diabetes mellitus canina, lo que podría conducir a futuras estrategias de tratamiento específicas.
Agradecimientos
Los autores agradecen a los doctores Jason Verbeck, Auldon Francis y Patty McElroy su ayuda en el reclutamiento de pacientes y la recogida de muestras. Los autores también agradecen al Dr. Christopher Fields su ayuda en el análisis de los datos.
Por: Nicole L. Laia, Patrick C. Barko, Drew R. Sullivan, Maureen A. McMichael, David A. Williams, Jennifer M. Reinhart.
(2022) Análisis longitudinal del microbioma rectal en perros con diabetes mellitus tras el inicio del tratamiento con insulina. PLoS ONE 17(9): e0273792. https://doi.org/10.1371/journal.pone.0273792
Editor: Jasbir Singh Bedi, Universidad de Ciencias Veterinarias y Animales Guru Angad Dev, INDIA
Copyright: © 2022 Laia et al
Por: Erik Farina (Etólogo Canino)
Contacto: psicolmascot@gmail.com
Copyright © Por: Erik Farina - Psicolmascot